Combustion process in the Boilers of steam Power plant
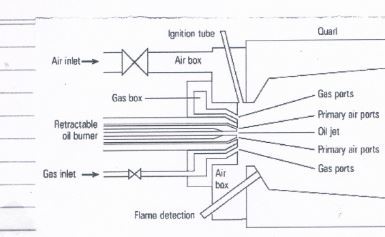
1 – أساسيات الاحتراق :<br /> تعريف الاحتراق : الاحتراق هو تأكسد سريع للوقود أو بعبارة أخرى هو أتحاد كيمياوي سريع للأوكسجين مع عناصر محددة , وهذه العناصر المحددة , هي العناصر التي يتكون منها الوقود . والأحتراق يحدث سريعا ويتطلب أقل درجة حرارة ليبدأ التفاعل .<br /> ومن أجل أحتراق فعال , العناصر المتفاعلة يجب أن تمزج مع الأوكسجين للوصول الى درجة حرارة مناسبة بوقت كافي للتفاعل . وهناك ثلاثة عوامل تؤثر على الأحتراق , هي <br />الاضطراب Turbulence , درجة الحرارة Temperature , الزمن Time . <br /> قواعد الأحتراق : أن أغلب أنواع الوقود المناسبة , هي كاربون وهيدروجين , وأحيانا توجد في بعض أنواع الوقود ( الكبريت Sulfur ) وهو يساهم في أنتاج الحرارة , لكن ينتج نواتج غيرمرغوبه , مثل ثاني أوكسيد الكبريت ( Sulfur dioxide ) . أن الوقود الغازي الهايدروكاربوني ( مثلا الميثان Methane CH4) , ينتج عند الأحتراق ( ثاني أوكسيد الكاربون وبخار الماء ) . الأوكسجين متوفر من الهواء , والهواء هو خليط . ويشكل النتروجين النسبه الأكبر من خليط الهواء . <br /> CH4 + 2O2 = CO2 + 2H2O + Heat ( 1 ) <br /> أما الوقود الكاربوني الصلب ( مثل الكاربون C ) , فأحتراقه ينتج Carbon dioxide <br /> C + O2 = CO2 + Heat ( 2 )<br /> As the following reaction formula indicates , partial or incomplete formula indicates partial or incomplete carbon combustion is accompanied , by the formation of carbon monoxide , a highly toxic gas : <br /> 2C + O2 = 2CO + Heat ( 3 ) <br /> If , on the other hand , excessive oxygen is supplied to the mixture , we say the mixture is weak and combustion is oxidative.<br /> <br /> Besides carbon dioxide and water vapor, other compounds are produced during combustion in smaller amounts , such as sulphur oxides , nitric oxides , carbon monoxide and metallic oxides , which are dealt with further on . <br /> 2- حسابات الاحتراق : <br /> 2-1 / فكرة المول Concept of the mole : <br /> كل عنصر يمتلك كتلة ذرية نوعية ( specific atomic mass ) , وكل مركب يمتلك كتلة مولية نوعية ( specific molecular mass ) .<br /> Carbon has an atomic mass of 12 , Oxygen an atomic mass of 16 while dioxide CO2 has a molecular mass of 44 . <br /> 2-2 / تركيب الهواء : <br /> الهواء الجوي يتكون من 78% نتروجين و 21 % أوكسجين و1% غازات أخرى , لذلك نسبة النتروجين الى الأوكسجين 3.76 . <br /> في جميع التطبيقات العملية للأحتراق , الأوكسجين يجهز من مكونات الهواء الجوي , وكذلك النتروجين يمر ولا يتفاعل , لذلك يظهر النتروجين في طرفي معادلة الأحتراق بنفس النسبه , لا يتغير , لذلك تكون معادلة أحتراق الكاربون , كما يلي : <br /> C + O2 + 3.76 N2 = CO2 + 3.76 N2 ( 4 )<br /> لكن , أذا أردنا تعادل الكتله , نستخدم فكرة المول , لنصل الى : <br /> 12kg C + 32kg O2 + 105.3kg N2 = 44 kg CO2 + 105.3 kg N2<br /> من هذه المعادلة , يمكن أن نحدد كمية الهواء المطلوبة لحرق كمية محددة من الوقود , لذلك , فأن نسبة الهواء الى الوقود ( air – fuel ratio ) :<br /> m air / mfuel = 11.44 kg air / kg fuel ( 5 )<br /> وهذه النسبه مهمة ( نسبه كيماوية ) ويطلق عليها stoichiometric , وتعني أن جميع الوقود يتفاعل كاملا مع جميع الأوكسجين . <br /> 2 -3 / متطلبات الهواء الزائد ( الفائض ) Excess air requirements <br /> ظروف الاحتراق الستيكوميترك Stoichiometric , هي الحالة المثالية التي يصعب الوصول أليها عمليا , عندما يستهلك الأوكسجين والوقود , المتفاعلات الباقية تصبح <br />أكثر مخففه وتتطلب وقت أكثر للتجانس في ما بينها , ونتيجة ذلك تبقى كميه محددة من الأوكسجين والوقود غير متفاعلة وتغادر وسط الاحتراق . <br /> لإيجاد حل لهذه المشكلة , نزيد قليلا كمية الهواء المجهزة للاحتراق عن القيمة النظرية , لذلك فأن الاحتراق الكامل سوف يتحقق , لكن بعض الأوكسجين الزائد يمر بالاحتراق ولا يتفاعل . أغلب عمليات الاحتراق فيها كميه من الهواء الزائد excess air والتي تدخل في حسابات الاحتراق , وتم تخمين هذه الكمية الزائدة ب 25% من الكمية النظرية theoretical لذلك تصبح كمية الهواء المستعملة للاحتراق هي 1.25 . <br /> لذلك فأن نسبة الهواء الزائد ( الفائض ) , هي :<br /> Excess air = (Actually air supplied-theoretical amount)/(theoretical amount ) ( 6 )<br />وإذا أردنا كتابة معادلة احتراق الكاربون : <br /> C + 1.25 ( O2 + 3.76 N2 ) = CO2 + 0.25 O2 + 4.7 N2 ( 7 ) <br /> Converting this to kilogram – mole to obtain a mass balance gives the following : <br /> 12kg C + 40kg O2 + 131.6kg N2 = 44kg C + 8kg O2 + 131.6kg N2 (8)<br /> The corresponding air – fuel ratio to give 25% air is then given by:<br /> mair / mfuel = 14.3kg air / kg fuel . <br /> For example , the stoichiometric burning of Propane ( C3H8 ) in Oxygen is :<br /> C3H8 + 5O2 = 3CO2 + 4H2O ( 9 )<br /> For example , the stoichiometric burning of Propane ( C3H8 ) in air is : <br /> C3H8 + 5O2 + 18.87N2 = 3CO2 + 4H2O + 18.87N2 ( 10 )<br /> 3 – القيمة الحرارية Calorific Value ( C V )<br /> تعرف القيمة الحرارية للوقود الصلب والوقود السائل , بأنها الحرارة المتولدة بالكيلو جول من الاحتراق الكامل لواحد كيلوغرام من الوقود . <br /> والقيمة الحرارية للوقود ’ نوعان , القيمة الحرارية العليا higher calorific value والقيمة الحرارية الواطئة lower calorific value . فالقيمة الحرارية العليا ( HCV ), <br />هي مجموع الحرارة المتحررة من مكونات الوقود , مثل الكاربون C والهيدروجين Hوالكبريت S , ومعادلتها : <br /> C V = 33780 C + 144200 H2 + 9280 S ( 11 )<br /> والقيمة الحرارية الواطئة ( LCV ) , أن الحرارة الكامنة نظرا لتشكل البخار من هيدروجين الوقود وأوكسجين الهواء , لذلك فأن الحرارة المسحوبة لتوليد البخار تقلل من كمية الحرارة المتولدة أصلا , والحرارة المتبقية هي القيمة الحرارية الواطئة . <br /> ومعادلتها : <br /> LCV = HCV - 9H2 × 2460 ( 12 ) <br /> 2460 KJ is the Latent heat of one kg of steam formed . <br /> 4 – السيطرة على الاحتراق Combustion Control <br /> لكي يكون الاحتراق مثالي , يجب أن تكون كمية الهواء الحقيقية أكثر من الكمية النظرية والتي تشترك بالتفاعل الكيماوي ( والكمية النظرية للهواء هي Stoichiometric air ). وهذه الزيادة في كمية الهواء نحتاجها لأكسدة جميع الوقود المتاح , ولكي نتفادا بقاء أي جسيمات من الوقود غير محترقة احتراق كامل , فالفرق بين كمية الهواء الحقيقية وكمية الهواء المثالية Stoichiometric هي كمية الهواء الزائدة excess air . وكقاعدة كميه الهواء الزائد تتراوح بين 5 % و 50% عن الستويكوميترك , وتعتمد على نوع الوقود ونوع الحارق Burner . أن عملية الاحتراق ( أكسدة الوقود ) عملية صعبة , لذلك نحتاج إلى هواء زائد الضروري لإكمال عملية الاحتراق التام , ولكن أيضا من الناحية الأخرى , فأن وجود كمية هواء زائد أكثر من المطلوب , سوف يؤدي إلى تذبذب كفاءة الاحتراق وكذلك إلى تخفف من غازات الاحتراق flue gases الناتجة والتي تؤدي إلى تقليل درجة الحرارة وتقليل كفاءة المرجل . الاحتراق يكون كامل وتام عند التحقق من أن أول أوكسيد الكاربون CO تكون وتم احتراقه . <br /> 5 – كفاءة الاحتراق : <br /> كفاءة الأحتراق تعرف بأنها نسبة بين الطاقة الحرارية المتحققة والطاقة الموجودة بالوقود : <br /> ɳcomb. = (energy supplied by combustion)/(primary energy used) ( 13 ) <br /> Primary energy is equal to the amount of fuel used for the calorific values .<br /> <br /> The difference between the primary energy used and the energy supplied by combustion is equal to the thermal energy contained in the flue gases produced by combustion.<br /> The efficiency of boiler ( ɳboiler ) can be calculated using the following formula : <br /> ɳboiler = 100 - Ps ( 14 ) <br /> Ps – thermal output lost through the flue pipe . <br /> 6 – شروط الاحتراق المثالي : <br /> 1 – كمية الهواء المجهزة كافية لحرق الوقود كاملا ( نسبة الوقود إلى الهواء نسبة مضبوطة ) .<br /> 2 - الهواء والوقود يجب أن يمزجا بصورة كاملة , وذلك باستخدام تيار هواء مضطرب , لكي يحصل امتزاج كامل . <br /> 3 – الوقود يجب أن يبقى في الفرن Furnace وقت كافي إلى أن يحصل احتراق كاملا <br /> 4 – حرارة الفرن يجب أن تكون كافية لكي تصل إلى درجة الاتقاد لخليط الوقود والهواء .<br />7 – مجموعة الحارق والفرن Furnace and Burner system : <br /> مجموعة الحارق يجب أن تضبط ويسيطر عليها , لكي نضمن أن التحول من الطاقة الكيماوية المتحررة من الوقود إلى الطاقة الحرارية تحصل بكفاءة عالية , وكذلك نضمن انتقال الحرارة إلى أنابيب المرجل انتقالا كاملا . <br /> الحارق Burner : <br /> الوقود يحترق داخل الحارق Burner , الحارق يستلم الوقود الذي يرذذ بواسطة البخار أو يرذذ ميكانيكا , وعملية الترذيذ عملية مهمة ولابد منها , لأنه لا يمكن للوقود أن يمتزج مع الهواء , بدون عملية ترذيذة . <br /> وهناك طريقتين لترذيذ الوقود : <br /> 1 – تسخين الوقود بواسطة البخار , أو بعبارة أخرى مزج البخار مع الوقود , حيث يؤدي هذا المزج إلى تبخر الوقود , لكي تحدث عملية مزجة مع الهواء . <br /> 2 – ترذيذ الوقود ميكانيكيا , وهناك عدة أجهزة لترذيذ الوقود بهذه الطريقة . <br /><br />وبصورة عامة , فأن ترذيذ الوقود Atomizing fuel يعني تجزئة الوقود إلى جسيمات صغيرة لكي تمتزج مع الهواء قبل الاحتراق . <br /> ومن الجدير بالذكر , أن الوقود يسخن قبل أن يصل إلى الحارق Burner , لكي نقلل من لزوجة الوقود , لكي تتم عملية المزج مع الهواء بكفاءة , وبالتالي نحسن من عملية الاحتراق <br /> هناك عدة أنواع من الحارق الميكانيكي , ونذكر نوعين فقط من هذه الأنواع , وهما <br /> 1 – Rotary Cup Burner : <br /> <br /> شكل رقم (1)<br /> في الشكل (1) يوضح هذا النوع من البيرنرات , حيث يجهز الوقود في أنبوب مركزي ويبثق الوقود داخل السطح الداخلي لمخروط دوار , ويجهز الهواء بواسطة مروحة . <br /> 2 – Dual fuel Burner حارق الوقود الثنائي <br />في الشكل (2) يوضح هذا النوع , يمكن باستعمال هذا النوع من البيرنارات , استخدام نوعين الوقود , أي يمكن ترتيب الجهاز لاستعمال أما الغاز الطبيعي Natural gas أو زيت الغاز ( الديزل ) fuel oil , أيهما متوفر يمكن أستخدامة , وممكن تحديد شكل الشعلة وأتجاهها , وتحسين ظروف المزج بين الهواء والوقود .<br /><br /><br /><br /><br /><br /> <br /> شكل رقم (2) <br /> وفي الشكل (3) صورة فوتوغرافية إلى Burner يستعمل في مراجل محطات القدرة , وهو بيرنر غازي , فيه نوزل مركزي لتوزيع الغاز . <br /> <br /> شكل (3)<br /> من الجدير بالذكر , أذا كان البويلر هو قلب المحطة , فأن البيرنر هو قلب البويلر , لأهميته في تنفيذ عملية الاحتراق في البويلر , وأمداد البويلر بالحرارة اللازمة لتحويل الماء الى بخار وتزويد المحطة بالحرارة المطلوبة لأجهزة المحطة المختلفة . <br /> مما تقدم فأن نتائج الاحتراق والتي هي الغازات المشتعلة ( الحارة ) Flue gases , لا يمكن أن تبقى قريبه من شعلة الاحتراق وأنما يجب تحريكها وتوجيهها إلى الأجزاء التي يجب أن ننقل أليها الحرارة المطلوبة , فهناك مروحتين , أحدهما قرب البيرنر في بداية الاحتراق وتسمى مروحة الدفع FDF , والمروحة الثانية , قرب قاعدة المدخنة Chimney وتسمى مروحة السحب IDF , لهذا فأن الغازات الحارة الناتجة من الاحتراق Flue gases تدفع بواسطة مروحة الدفع , فتمر هذه الغازات على أنابيب البويلر الداخلية والتي تحدث فيها عملية التبخير Evaporation process والتي تسمى Riser tubes , وبعدها تمر هذه الغازات <br /> الحارة على أنابيب المحمص Superheater , وبعدها على أنابيب ( معيد التسخين ) Reheater وبعدها تمر على أنابيب المقتصدة Economizer , وثم تمر هذه الغازات الحارة على مسخن الهواء Air preheater , ثم تسحب هذه الغازات الحارة , بعد أن استنفذنا معظم الطاقة الحرارية التي فيها , بواسطة مروحة السحب IDF وتقذف إلى الجو بواسطة المدخنة Chimney .<br /> مع التقدير <br /><br /> تشرين الأول 2020 <br />أ.م.د عبد الكريم عبد الوهاب <br />جامعة المستقبل -هندسة تقنيات ميكانيك القوى <br />