مقالة علمية للاستاذ الدكتور ناصر عبد الحسن ناصر بعنوان( دور مركبات الأورغانوتين في تصميم الأدوية وتطويرها
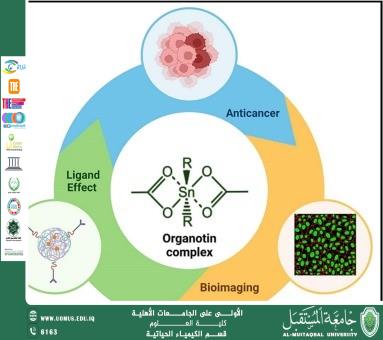
لقد حازت مركبات الأورغانوتين، التي هي مركبات عضوية تحتوي على المعادن، على اهتمام كبير في مجال كيمياء الأدوية نظرًا لخصائصها الفريدة. وقد أظهرت هذه المركبات، وخاصة مشتقات Triorganotin (IV)، نشاطات بيولوجية واعدة، بما في ذلك النشاط المضاد للبكتيريا، مضاد للسرطان، ومضاد للالتهابات. لذلك أصبح دراسة وتطبيق مركبات الأورغانوتين في تصميم الأدوية مجالًا بحثيًا متزايدًا، مما يوفر إمكانيات لتطوير أدوية علاجية جديدة.<br /><br />مركبات الأورغانوتين: الهيكل والخصائص<br />تتكون مركبات الأورغانوتين من ذرة القصدير مرتبطة بثلاث مجموعات عضوية، عادة ما تكون مجموعات ألكيلية أو أريل. الشكل الأكثر شيوعًا في التطبيقات الصيدلانية هو Triorganotin (IV)، حيث يتم ربط القصدير بثلاث مجموعات تحتوي على الكربون وعادة ما يكون منسقًا إلى رابطة مع جزيء، مثل مضاد حيوي أو جزيء بيولوجي نشط.<br />تتمتع هذه المركبات بخصائص فيزيائية وكيميائية مميزة، بما في ذلك قابلية ذوبان عالية في الدهون، مما يسمح لها بالاختراق بسهولة عبر الأغشية البيولوجية. بالإضافة إلى ذلك، يمكن أن يتفاعل مركز المعدن مع العديد من الجزيئات البيولوجية، بما في ذلك البروتينات والأحماض النووية، مما يؤدي إلى فوائد علاجية محتملة.<br /><br />تطبيقات مركبات الأورغانوتين في تصميم الأدوية<br />1. النشاط المضاد للبكتيريا:<br />تم دراسة مركبات الأورغانوتين على نطاق واسع لنشاطها المضاد للبكتيريا، خاصة في محاربة البكتيريا والفطريات. ويُعزى قدرتها على تثبيط نمو الكائنات الدقيقة إلى تفاعل أيون القصدير مع الهياكل الخلوية، مما يعطل العمليات الأيضية الطبيعية.<br />2. خصائص مضادة للسرطان:<br />أظهرت مركبات Triorganotin تأثيرات مضادة للسرطان كبيرة. يُعتقد أن هذه المركبات تعمل عن طريق التفاعل مع الحمض النووي والإنزيمات المشاركة في انقسام الخلايا، مما قد يمنع تكاثر خلايا السرطان. وأظهرت الأبحاث أن الأدوية القائمة على الأورغانوتين قد تتغلب على بعض القيود المرتبطة بالعلاج الكيميائي التقليدي.<br />3. الخصائص المضادة للالتهابات:<br />تم أيضًا دراسة الإمكانات المضادة للالتهابات لمركبات الأورغانوتين، حيث أظهرت بعض المركبات فعاليتها في تقليل الالتهاب عن طريق تعديل الاستجابات المناعية ومنع مسارات الالتهاب.<br />4. التنسيق مع المضادات الحيوية:<br />غالبًا ما يتم تحضير مركبات الأورغانوتين عن طريق تنسيق ذرة القصدير مع مضادات حيوية مثل أمبيسيلين. يعزز هذا المزيج النشاط البيولوجي لكل من مركب الأورغانوتين والمضاد الحيوي، مما يؤدي إلى إنشاء عوامل مضادة للبكتيريا أكثر فعالية.<br /><br />تحضير وتوصيف مركبات الأورغانوتين<br />يشمل تحضير مركبات الأورغانوتين عادةً تفاعل هاليدات القصدير مع الجزيئات العضوية. يمكن تعديل هذه العملية لإنتاج مركبات ذات نشاطات بيولوجية مرغوبة. بمجرد تحضيرها، تخضع هذه المركبات لتقنيات توصيف واسعة النطاق، بما في ذلك الطيف الشمسي للأشعة فوق البنفسجية (UV-Vis)، الأشعة تحت الحمراء (FTIR)، والتحليل الطيفي بالرنين المغناطيسي النووي (NMR)، والطيف الكتلي (Mass Spectrometry). تساعد هذه الطرق في تأكيد الهيكل والنقاء والثبات للمركبات، مما يضمن مطابقتها للمعايير المطلوبة لاختبارات الفعالية الصيدلانية.<br /><br />التحديات والاتجاهات المستقبلية<br />على الرغم من الإمكانات الواعدة لمركبات الأورغانوتين في تصميم الأدوية، هناك العديد من التحديات التي يجب التغلب عليها. من أبرز هذه المخاوف هو سمية بعض مركبات الأورغانوتين، خاصة عند الجرعات العالية. لذا، هناك حاجة ماسة لدراسات شاملة حول ملفات الأمان والحرائك الدوائية لهذه المركبات لتحديد مدى صلاحيتها كعوامل علاجية.<br />علاوة على ذلك، يعد تطوير أدوية تعتمد على الأورغانوتين أكثر انتقائية وأقل سمية أمرًا بالغ الأهمية. قد توفر التقدمات في تكنولوجيا النانو وأنظمة توصيل الأدوية المستهدفة حلولًا لتحسين فعالية هذه المركبات وتقليل آثارها الجانبية.<br />تتمتع مركبات الأورغانوتين بإمكانات كبيرة في مجال تصميم الأدوية وتطويرها نظرًا لأنشطتها البيولوجية المتنوعة. مع استمرار البحث والتطوير، قد تفتح هذه المركبات الطريق لإنشاء أدوية علاجية جديدة وأكثر فعالية، خاصة في مجالات مكافحة البكتيريا، السرطان، والعلاج المضاد للالتهابات. ومع استمرار تعزيز فهمنا لهذه المركبات وآلية عملها، يصبح من الواضح بشكل متزايد الإمكانيات الكبيرة لمركبات الأورغانوتين في التطبيقات السريرية.<br /><br /><br /> <br /><br />جامعة المستقبل الجامعة الاولى في العراق<br />